Jak zestawu czterech liczb kwantowych dołożymy zakaz Pauliego, można spróbować „wygenerować” układ okresowy. Spróbujemy się zabawić w konstruktora konfiguracji elektronowej mając liczby opisane w poprzedniej notce i wspomniany zakaz Pauliego. Czyli bierzemy jądro o ładunku Z i próbujemy umieścić wokół niego Z elektronów, zakładając sobie przy tym, przynajmniej na początku, że stany elektronów w tych atomach są „podobne” do stanów w atomie wodoru – z punktu widzenia rachunków oznacza to, że zaniedbujemy oddziaływanie pomiędzy elektronami. To brutalne ograniczenie, ale jak zabawa, to zabawa – od razu napiszę, że dla samej konstrukcji układu okresowego założenie stanie się istotne dopiero przy trzecim okresie, czyli dla atomów powyżej liczby atomowej Z>10
Żeby zabawa się udała, trzeba jeszcze założyć, że im większa liczba l tym większa energia elektronu, oprócz tego regułę Hundta o ułożeniu spinów, no i najważniejsze: że atomy najbardziej lubią przebywać w swoich stanach podstawowych czyli w stanach o najmniejszej energii. Elektrony o podobnych energiach[1] pogrupujemy w tzw. powłoki.
Startujemy. Mamy jeden elektron i jądro. Najniższa możliwa energia wymusza, że będzie miał liczbę kwantową n = 1. Narzuca to ograniczenie na liczby l i m związane z momenty pędą – obie muszą być równe zero. Liczba spinowa jest dowolna[2]. Dokładamy drugi elektron, by zrobić sobie atom helu. Patrzymy gdzie mógłby mieć najniższą energię – ano też w stanie n = 1, l = 0, m = 0 tylko liczbę spinową będzie miał przeciwną do tego pierwszego. Tym sposobem zapełniliśmy tzw. pierwszą powłokę tworząc gaz szlachetny[3]. Tym sposobem określiliśmy konfigurację pierwszego okresu – składa się z dwóch pierwiastków.
| n |
1
|
2
|
| l |
0 (1s)
|
0 (2s)
|
1 (2p)
|
| m |
0
|
0
|
–1
|
0
|
1
|
| H wodór (Z = 1) |
↑ |
|
|
|
|
| He hel (Z = 2) |
↑ ↓ |
|
|
|
|
Konfiguracje elektronowe z „tradycyjnym” przedstawieniem liczb spinowych jako strzałek – tak jak w książce z chemii.
Bierzemy się atom z Z = 3 (lit). Konfiguracja dwóch pierwszych elektronów pokrywa się z atomem helu, dokładamy trzeci. Najniższe dostępne miejsce, to n = 2, l = 0, m = 0. Dla n = 2 możliwe są również stany gdy l = 1, ale mają większą energię. Dla Z = 4 (beryl) następny elektron (te same liczby n = 2, l = 0, m = 0 i przeciwnie skierowana liczba spinowa) zapełni kolejną podpowłokę s. Procedurę układania następnych elektronów pominę pokazując jedynie wynik w tabeli:
| n |
1
|
2
|
| l |
0 (1s)
|
0 (2s)
|
1 (2p)
|
| m |
0
|
0
|
–1
|
0
|
1
|
| Li lit (Z = 3) |
↑ ↓ |
↑ |
|
|
|
| Be beryl (Z = 4) |
↑ ↓ |
↑ ↓ |
|
|
|
| B bor (Z = 5) |
↑ ↓ |
↑ ↓ |
↑ |
|
|
| C węgiel (Z = 6) |
↑ ↓ |
↑ ↓ |
↑ |
↑ |
|
| N azot (Z = 7) |
↑ ↓ |
↑ ↓ |
↑ |
↑ |
↑ |
| O tlen (Z = 8) |
↑ ↓ |
↑ ↓ |
↑ |
↑ |
↑ ↓ |
| F fluor (Z = 9) |
↑ ↓ |
↑ ↓ |
↑ |
↑ ↓ |
↑ ↓ |
| Ne neon (Z = 10) |
↑ ↓ |
↑ ↓ |
↑ ↓ |
↑ ↓ |
↑ ↓ |
Konfiguracje elektronowe dla okresu drugiego. Widać związek pomiędzy liczbą
n a numerem okresu.
Sposób wypełniania podpowłoki p (l = 1) dla kolejnych pierwiastków ustala reguła Hundta, o której więcej napiszę w następnej notce. Chodzi o to, że po w przypadku gdy podpowłoka nie jest całkowicie zapełniona, suma spinów musi mieć maksymalną wartość – czyli elektrony w podpowłoce muszą być maksymalnie niesparowane.
Trochę delikatnie należy potraktować rozmieszczanie elektronów w podpowłoce ze względu na liczbę m. Dopóki nie mamy wyróżnionego kierunku (np. w postaci zewnętrznego pola magnetycznego) kolejność mogła by być dowolna, ale istnieje przecież kierunek wypadkowego spinu[4], więc uwzględniając oddziaływanie pomiędzy orbitalnym a spinowym momentem magnetycznym podpowłoki, można przyjąć, że badamy składową L właśnie względem tego kierunku. Muszę napisać, że podręczniki (a zajrzałem do kilku z chemii i fizyki) szafujące klatkowymi obrazkami konfiguracji elektronowej nie skupiają się ne tym problemie. Napiszę więcej: dane były sprzeczne. Uzupełniłem dane tak, by pasowały do reguły Hundta.
Metoda Hatree-Focka
Dwa pierwsze okresy w 100% odtwarzają strukturę wyliczoną dla atomu wodoru. Dla następnych okresów już tak nie jest. Nie jest to dziwne, skoro zaniedbaliśmy oddziaływanie między elektronami. Zapełnianie możliwych stanów, jakie dostaliśmy z analizy atomu wodoru robione było z „punktu widzenia jądra”. Natomiast spojrzenie „od strony elektronów” wygląda nieco inaczej: elektrony znajdujące się bliżej jądra ekranują jego ładunek dodatni. Czyli elektrony na wyższych powłokach nie czują całego ładunku jądra, bo te z niższych powłok częściowo go zrównoważyły.
Wprowadzenie tego pomysłu do aparatu obliczeniowego zawdzięczamy sporej grupie fizyków, z których najbardziej znani są Hartree i Fok. Właśnie ich nazwiskami nazwano metodę, która uwzględnia efekt ekranowania jądra [5]. Obliczone funkcje falowe w dalszym ciągu można parametryzować liczbami n, l, m i s, ale okazuje się, że energie silnie zależą od liczby l, co na przykład powoduje, że elektrony z orbitali d (l = 2) i n = 3 mają większą energię od tych z orbitala s (l = 0) dla n = 4. Oznacza to, że przy odtwarzaniu układu okresowego trzeba będzie uważać i przy ustalaniu zawartości powłok brać pod uwagę nie tylko liczbę n, jak w przypadku dwóch pierwszych okresów.
Jak komuś się chce, to może samemu wyrysować sobie konfiguracją elektronową dowolnego pierwiastka, pamiętając o kolejności konfiguracji (poniżej mały cytat za licealną książką z chemii, poprawiłem flamastrem obrazek, bo był całkowicie niejasny):
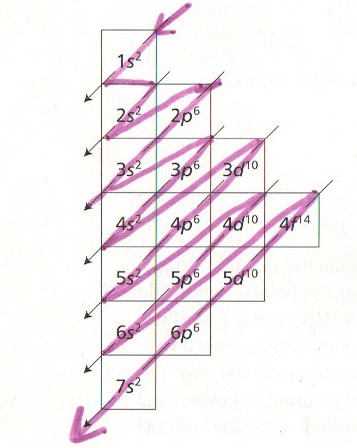
Trzeba zachować przy tym trochę ostrożności, bo im więcej elektronów, tym więcej wyjątków w postaci tzw. promocji.
Im dalej w las
Żeby nie było, że sukces goni sukces, napiszę teraz o problemach. Napisałem w poprzednim odcinku, że złożoność rachunkowa równania Schrodingera/Pauliego szybko rośnie z liczbą atomową Z, więc trzeba stosować przybliżenia. Problem pojawia się, gdy trzeba uzasadnić wybór takiej a nie innej metody przybliżeń – na przykład porządne uzasadnienia metody Hatree-Focka pokazujące, na ile jego rozwiązanie może różnić się od rozwiązania ścisłego, pojawiły się kilka dekad po powstaniu metody.
Do tego dochodzi problem skali: Energia elektronów jest z grubsza proporcjonalna do kwadratu ładunku jądra Z2, powoduje to, że dla dużych Z (ujemne) energie termu sięgają już MeV. Różnice energii mające wpływ na własności chemiczne i fizyczne – te dotyczące elektronów z powłoki walencyjnej – są rzędu eV. Żeby oddać strukturę poziomów energetycznych, by wyniki obliczeń mogły być przydatne, dokładność obliczeń musiałaby sięgać malutkiego ułamka promila. Co prawda w wielu przypadkach wystarcza ograniczenie się do ostatniej powłoki, ale wiele interesujących spraw tkwi i w niższych poziomach elektronowych.
Elektrony czy term?
Na koniec jeszcze małe wytłumaczenie. Uważniejszy czytelnik przypomni sobie, że jak cząstki są nierozróżnialne – co skutkuje zakazem Pauliego – to raczej nie powinno się mówić, że w danym stanie jest jeden elektron, w innym drugi, a jeszcze w innym następny. Rzeczywiście ścisły opis takiego układu mówi, że mamy układ kilku elektronów znajdujących się w jednym stanie „zbiorczym” ≡ konfiguracji ≡ termie. W ścisłym podejściu nie powiemy, że każdy z elektronów ma swoją poszczególną energię, ale że cały układ czyli term ma jedną „zbiorczą” energię.
Zobaczmy jednak, typowe postępowanie odtwarzające taki stan zbiorowy. Dla uproszczenia wyprowadzeń – wszak ma to być poglądowy szkic – zaniedbam spin i ograniczę się do dwóch cząstek. Startuje się od przybliżenia: stan termu jest „podobny” do układu: Obie cząstki są w stanach „wodoropodobnym”. Pierwszy ma liczby kwantowe nα, lα, i mα. Zbiorczo te liczby oznaczę sobie symbolem α (bo trudno byłoby pisać wzór, gdzie indeks ma jeszcze jeden indeks). Liczby drugiego elektronu oznaczę sobie jako β (mając na myśli: nβ, lβ, i mβ,). Mam więc dwie wyjściowe funkcje falowe φα i φβ. Kandydat na stan termu jak ma się składać z tych dwóch i jeszcze ma spełniać zakaz Pauliego – funkcja falowa ma być antysymetryczna ze względu na zamianę cząstek. Spełnienie obu warunków zapewnia:
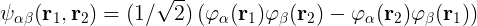
Teraz do równania dołącza się człony odpowiedzialne za odpychanie między elektronami i liczy poprawki. No i okazuje się, że te poprawki nie psują parametryzacji za pomocą liczb (nα, lα, mα) i (nβ, lβ, mβ). Wciąż można używać reprezentacji liczb kwantowych. Obliczony stan jest „podobny” do stanu od którego wychodziliśmy w obliczeniach, choć jego postać matematyczna (jest jak widać splątany na całego ☺) może sugerować coś innego.
Dlatego też zarówno fizycy jak i chemicy używają powszechnie stwierdzeń, że dany elektron znajduje się na takiej a nie innej powłoce, podpowłoce… Nawet jeśli powiedzenie takie nie jest do końca ścisłe.
[1] Jak nie będziemy zaniedbywać wzajemnego oddziaływania elektronów, to pojęcie energii pojedynczego elektronu nie ma sensu. Podejście ścisłe bowiem operuje energią układu wszystkich elektronów. Taki „zbiorczy” stan nazywa się termem i nie da się jego energii rozdzielić na sumę energii poszczególnych elektronów. No bo gdzie przydzielić energię odpychania między elektronami?
[2] W dokładności wymaganej przez chemię, póki nie włączymy zewnętrznego pola magnetycznego energia elektronu w atomie wodoru nie zależy od liczby spinowej. Ale jak się dokładniej przyjrzeć, to elektron znajduje się słabym w polu magnetycznym jądra. Powoduje to zróżnicowanie energii. Przeskoki między tymi poziomami są obserwowane jako słynne promieniowanie 21cm. W naszej zabawie możemy jednak zignorować ten efekt.
[3] Wszelkie zmiany chemiczne zmieniają konfigurację elektronową i przy zapełnionych powłokach jest to trudne – zabrana czy dostarczona porcja energii byłaby zbyt duża, żeby atomy te w miarę chętnie tworzyły związki chemiczne.
[4] Żeby nie drażnić osób wyobrażających sobie spin klasycznie, trzeba zaznaczyć, że chodzi o kierunek w którym dany stan spinowy jest stanem własnym operatora spinowego momentu pędu z największą wartością własną.
[5] Wprowadzenie ekranowania jądra przez Hartree’go i Foka to pierwsza poprawka do modelu nieoodziałujących elektronów. Żeby model był jak najbardziej zbliżony do rzeczywistości wprowadza się kolejne poprawki uwzględniające np. oddziaływanie elektronów z polem magnetycznym utworzonym przez inne elektrony. W terminologii atomowej nazywa się to sprzężeniami j-j i L-S.
Inne tematy w dziale Technologie

